 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

出国看病:治疗白血病,CAR-T细胞治疗方法方法方法MB-102获美国FDA批准开展新药I/II期临床试验
【本文为疾病百科知识,仅供阅读】 2019-08-08 作者:厚朴方舟
Mustang Bio是一家临床阶段的生物制药公司,专注于开发细胞和基因治疗方法用于血液学癌症、实体瘤和罕见遗传病的治疗。近日该公司宣布,美国食品和药物管理局(FDA)已批准MB-102(CD123 CAR T)的新药临床试验申请(IND),启动一项多中心I/II期临床试验,评估MB-102治疗急性髓性白血病(AML)、母细胞性浆细胞样树突状细胞肿瘤(BPDCN)、高危骨髓增生异常综合症(MDS)。之前,FDA已授予MB-102治疗AML和BPDCN的孤儿药资格(ODD)。

MB-102(CD123 CAR T)是一种CAR T细胞治疗方法方法方法,对患者T细胞进行工程化以识别和消除表达CD123的肿瘤细胞。CD123广泛表达于骨髓增生异常综合征以及血液恶性肿瘤患者的骨髓细胞,包括急性髓性白血病(AML)、B细胞急性淋巴细胞白血病(B-ALL)、毛细胞白血病(HCL)、BPDCN、慢性髓细胞白血病(CML)和霍奇金淋巴瘤(HL)。
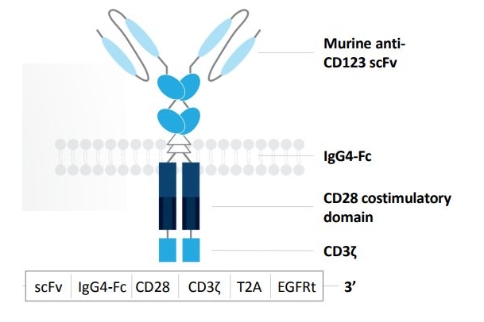
MB-102结构示意图
CD123表达于75-89%的AML、超过90%的BPDCN患者中,因此是T细胞过继免疫治疗方法方法的一个非常有吸引力的靶点。在美国希望之城(City of Hope)开展的一项研究者发起的I期临床试验中,MB-102在这些患者的早期小群体中显示出有希望的应答率。
根据美国癌症协会(ACS)的数据,2018年美国估计有19520例新的AML病例,该病的五年生存率估计为25%。在2016年,美国血液学会(ASH)教育项目文章报告称,美国每年约有700例新的BPDCN病例,欧洲每年有1000例,平均生存期为12-14个月。
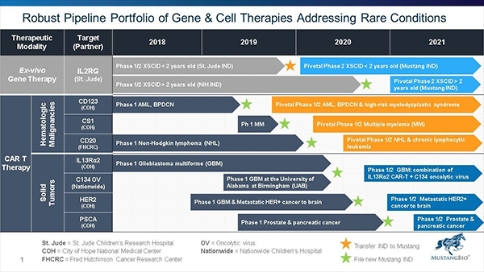
Mustang Bio公司管线资产
根据2017年12月美国血液学会(ASH)年会和2018年12月美国癌症研究协会(AACR)肿瘤免疫和免疫治疗方法方法特别会议上的报告,在希望之城开展的 人体临床试验(NCT02159495)中,MB-102以低剂量治疗AML和BPDCN时表现出完全缓解,并且不存在剂量限制性毒性。目前,该研究中2种适应症的剂量递增正在进行中。
Mustang Bio总裁兼首席执行官、医学博士Manuel Litchman表示:“FDA批准了我们对MB-102的IND申请,这是公司实现的一个重要里程碑,因为这是我们的靠前个IND。我们很高兴在2019年晚些时候启动我们的多中心I/II期临床试验,并在我们的制造工厂对患者细胞进行处理,该工厂于2018年6月开放。我们热衷于满足AML、BPDCN和MDS患者中的需求,并期待进一步开发MB-102以帮助解决这些毁灭性疾病。”
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:出国看病:治疗胃肠道间质瘤新药avapritinib向美FDA递交申请,获优先审评资格 下一篇:出国看病:中重度暴饮暴食药物已在申请,现已进入审查阶段
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号