 全球服务热线:400-086-8008
全球服务热线:400-086-8008- 日本语
 全球服务热线:400-086-8008
全球服务热线:400-086-8008

首页 > 美国看病 > 美国医学前沿 > 2021年肺癌靶向治疗及免疫治疗进展大盘点
2021年肺癌靶向治疗及免疫治疗进展大盘点
【本文为疾病百科知识,仅供阅读】 2021-12-31 作者:厚朴方舟
肺癌是全球常见的癌症类型之一,治疗方法的不断进步为肺癌患者带带来了新的治疗选择,也显著延长了肺癌患者的生存期。2021年已经接近尾声,这一年虽然疫情依旧未平复,但是有关肺癌治疗的研究仍在不断推进。在2022年即将来临之际,厚朴方舟整理了2021年肺癌靶向治疗与免疫治疗的突出成果,希望能为肺癌患者及家属提供些许帮助。
▲图源:medicinenet
一、多款靶向药物接连获批,罕见靶点打破“无药可医”现状
1.全球头一个KRAS靶向药获批上市
KRAS基因突变是较早发现的致癌基因突变之一,也是人类癌症中较常见的致癌基因突变,但是,KRAS长期以来几乎无法被攻克,成为了肿瘤药研发领域“不可成药”靶点之一。
今年5月,美国食品和药物管理局(FDA)批准靶向抗癌药Lumakras(sotorasib,AMG 510)用于治疗先前已接受过至少一种系统治疗、经FDA批准的检测方法证实存在KRAS G12C突变、局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,是头一个也是仅有的一个被批准用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌患者的靶向治疗方法。
▲图源:参考来源[1]
2.两款针对EGFR外显子20插入突变的药物接连获批,实现“从无到有”
EGFR第20号外显子插入突变患者仅占NSCLC患者的1-2%,十分罕见,且相比其他EGFR突变,EGFR第20号外显子插入突变患者预后更差。此前,一直没有针对第20外显子突变的治疗方法,当前可用的EGFR-TKI和化疗对这类患者的益处有限。
今年,两款针对EGFR外显子20插入突变的药物接连被美国FDA获批,标志着EGFR外显子20插入突变患者将迎来新的转机,不再无药可医!
Rybrevant:今年5月,美国食品和药物管理局(FDA)批准EGFR-MET双特异性抗体Rybrevant(amivantamab-vmjw),用于治疗接受含铂化疗失败后病情进展、EGFR基因外显子20插入突变阳性的转移性非小细胞肺癌成人患者。
Exkivity:今年9月,美国食品和药物管理局(FDA)已批准创新药物Exkivity(mobocertinib,TAK-788),用于治疗先前接受含铂化疗期间或之后病情进展、经FDA批准的检测方法证实为EGFR基因外显子20插入突变阳性的局部晚期或转移性非小细胞肺癌成人患者。
3.罕见靶点迎来新突破,全球迎来头一款MET抑制剂
根据统计,MET信号通路改变仅发生在3-5%的非小细胞肺癌病例中,是名副其实的罕见靶点(截止到目前,已发现的3种MET信号通路改变分别为METex14跳跃改变、MET扩增、MET蛋白过度表达)。
今年2月,美国食品和药物管理局(FDA)已批准靶向抗癌药Tepmetko(tepotinib),用于治疗携带MET基因第14号外显子跳过改变(METex14 skipping)的晚期非小细胞肺癌(NSCLC)成人患者。Tepmetko成为全球头一个被批准用于治疗携带MET基因改变的晚期非小细胞肺癌患者的口服MET抑制剂。

▲图源:参考来源[4]
免疫治疗全面改变肺癌治疗格局
1.肺癌一线治疗迎来新突破
今年3月,美国食品和药物管理局(FDA)已批准抗PD-1治疗Libtayo(cemiplimab),用于一线治疗肿瘤高表达PD-L1(肿瘤比例得分[TPS]≥50%)的晚期非小细胞肺癌患者,具体为:肿瘤高表达PD-L1(TPS≥50%)、有转移性或局部晚期肿瘤、不适合手术切除或根治性放化疗、肿瘤无EGFR、ALK或ROS1畸变的NSCLC患者。
研究结果显示,在≥50%肿瘤细胞表达PD-L1的局部晚期或转移性非小细胞肺癌患者中,与含铂双效化疗相比,Libtayo一线治疗显著延长了总生存期。

▲图源:参考来源[5]
2.头一个辅助治疗非小细胞肺癌的免疫治疗药物获批
今年10月,美国食品和药物管理局(FDA)已批准抗PD-L1治疗Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠单抗):用于肿瘤表达PD-L1≥1%的II-IIIA期非小细胞肺癌(NSCLC)成人患者,作为手术和铂类化疗后的辅助治疗。
Tecentriq是头一个也是仅有的一个被批准用于辅助治疗非小细胞肺癌的癌症免疫治疗,将开创一个新的时代。
3.去化疗化,双免疫治疗4年数据披露,效果显著!
今年5月,研究人员公布了评估抗PD-1治疗Opdivo(欧狄沃,通用名:nivolumab,纳武利尤单抗)联合抗CTLA-4治疗Yervoy(ipilimumab,易普利姆玛)一线治疗晚期非小细胞肺癌(NSCLC)3期CheckMate-227试验(NCT02477826)的4年数据。
结果显示,随访4年以上(49.4个月),无论肿瘤PD-L1表达水平或组织学如何,与化疗相比,双重免疫治疗Opdivo+Yervoy显示出持久长期生存益处,4年生存率增加一倍以上。
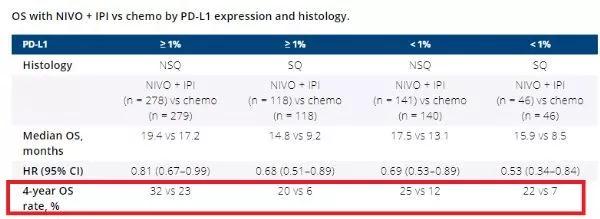
▲图源:参考来源[7]
另外,“O药+Y药+两个周期化疗”的三联组合治疗也在今年迎来新的进展,权威医学杂志《Journal of Clinical Oncology》发布的研究指出,同化疗相比,三联方案显著延长了患者的中位生存期(15.8个月 vs 11个月)和中位无进展生存期(6.7个月 vs 5.3个月),提高了生存率(2年生存率:38% vs 26%)。而且无论PD-L1是阴性还是阳性,无论是鳞癌还是非鳞癌,都可以从中获益。

▲图源:参考来源[8]
三、2022年肺癌治疗重点方向盘点
1.Opdivo+化疗新辅助(术前)免疫治疗
今年11月,3期CheckMate-816试验公布的结果显示,在可切除IB-IIIA期非小细胞肺癌(NSCLC)中,用于新辅助(术前)治疗时,与化疗相比,抗PD-1治疗Opdivo(nivolumab,纳武利尤单抗)与化疗联合用药方案使无事件生存期显著改善。免疫治疗有望成为肺癌新辅助治疗的重要方法。
2.Enhertu有望成为全球头一个HER2靶向治疗
近日,全球3期临床试验DESTINY-Lung04已对一例患者进行了给药治疗,该试验在先前没有接受过治疗的HER2突变不可切除性局部晚期或转移性非小细胞肺癌(NSCLC)患者中开展,正在评估Enhertu(trastuzumab deruxtecan)用于一线治疗的效果和安全性。如果后续获得批准,Enhertu将成为头一个被批准用于治疗非小细胞肺癌的HER2靶向治疗。
3.创新靶向药改善小细胞肺癌预后效果
今年4月,靶向抗癌药berzosertib(M6620)的关键临床进展公布,berzosertib可通过阻断癌细胞中的ATR活性,阻止癌细胞修复化疗导致的DNA损伤,从而诱导癌细胞死亡、肿瘤消退,增强化疗的效果。
结果显示,berzosertib(ATR抑制剂)联合化疗拓扑替康(TOP1抑制剂)治疗复发性小细胞肺癌(SCLC)患者效果显著,客观缓解率(ORR)达36%。特别是,在病情缓解的铂耐药患者中,大部分患者表现出持久缓解。
总而言之,今年多款药物的获批,将为肺癌患者带来新的治疗方向,显著延长患者的生存期。未来,研究人员将继续探索有关肺癌治疗的研究,旨在让更多肺癌患者受益。
对于备受肺癌困扰的患者,寻找权威的医院及医生诊治,了解全球先进的治疗药物,或许可以找到更有效的、延长生存期的治疗方案。厚朴方舟作为海外医疗服务机构中的佼佼者,与肺癌世界知名的专家久保田馨教授、铃木健司教授均有着深入的合作关系,已经为许许多多的肺癌患者提供服务,帮助患者延长生存期。如希望了解更多肺癌治疗前沿资讯,或想预约肺癌专家诊治的朋友,可以拨打热线400-086-8008联系我们。
参考来源:
[1]FDA Approves LUMAKRAS™ (Sotorasib), The First And Only Targeted Treatment For Patients With KRAS G12C-Mutated Locally Advanced Or Metastatic Non-Small Cell Lung Cancer
https://www.prnewswire.com/news-releases/fda-approves-lumakras-sotorasib-the-first-and-only-targeted-treatment-for-patients-with-kras-g12c-mutated-locally-advanced-or-metastatic-non-small-cell-lung-cancer-301301808.html
[2] FDA Approves First Targeted Therapy for Subset of Non-Small Cell Lung Cancer | FDA
https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-subset-non-small-cell-lung-cancer
[3] Takeda’s EXKIVITY™ (mobocertinib) Approved by U.S. FDA as the First Oral Therapy Specifically Designed for Patients with EGFR Exon20 Insertion+ NSCLC
https://www.takeda.com/newsroom/newsreleases/2021/takeda-exkivity-mobocertinib-approved-by-us-fda/
[4]FDA Approves TEPMETKO® as the First and Only Once-daily Oral MET Inhibitor for Patients with Metastatic NSCLC with METex14 Skipping Alterations
https://www.prnewswire.com/news-releases/fda-approves-tepmetko-as-the-first-and-only-once-daily-oral-met-inhibitor-for-patients-with-metastatic-nsclc-with-metex14-skipping-alterations-301221542.html
[5]FDA approves cemiplimab-rwlc for non-small cell lung cancer with high PD-L1 expression | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-cemiplimab-rwlc-non-small-cell-lung-cancer-high-pd-l1-expression
[6] Roche - US FDA approves Roche’s Tecentriq as adjuvant treatment for certain people with early non-small cell lung cancer
https://www.roche.com/investors/updates/inv-update-2021-10-15b.htm
[7] Bristol Myers Squibb - Four-Year Data from Phase 3 CheckMate -227 Trial Show Durable, Long-Term Survival with Opdivo(nivolumab) Plus Yervoy (ipilimumab) in Patients with Non-Small Cell Lung Cancer with PD-L1 Expression ≥1%
https://news.bms.com/news/details/2021/Four-Year-Data-from-Phase-3-CheckMate--227-Trial-Show-Durable-Long-Term-Survival-with-Opdivonivolumab-Plus-Yervoy-ipilimumab-in-Patients-with-Non-Small-Cell-Lung-Cancer-with-PD-L1-Expression-1/default.aspx
[8]DOI: 10.1200/JCO.2021.39.15_suppl.9000 Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 9000-9000.
[9]Bristol Myers Squibb - Neoadjuvant Opdivo (nivolumab) Plus Chemotherapy Significantly Improves Event-Free Survival in Patients with Resectable Non-Small Cell Lung Cancer in Phase 3 CheckMate -816 Trial
https://news.bms.com/news/corporate-financial/2021/Neoadjuvant-Opdivo-nivolumab-Plus-Chemotherapy-Significantly-Improves-Event-Free-Survival-in-Patients-with-Resectable-Non-Small-Cell-Lung-Cancer-in-Phase-3-CheckMate--816-Trial/default.aspx
[10] DESTINY-Lung04 Phase 3 Trial of ENHERTU® Initiated in Patients with Previously Untreated HER2 Mutant Metastatic Non-Small Cell Lung Cancer | BioSpace
https://www.biospace.com/article/releases/destiny-lung04-phase-3-trial-of-enhertu-initiated-in-patients-with-previously-untreated-her2-mutant-metastatic-non-small-cell-lung-cancer/
[11]EMD Serono Advances ATR Inhibitor Berzosertib in Small Cell Lung Cancer With New Published Data and Initiation of Phase II Trial With Registrational Intent | BioSpace
https://www.biospace.com/article/releases/emd-serono-advances-atr-inhibitor-berzosertib-in-small-cell-lung-cancer-with-new-published-data-and-initiation-of-phase-ii-trial-with-registrational-intent/
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
热门服务
推荐阅读
美国权威医学专家
美国医院排名
 全球咨询服务热线
全球咨询服务热线
400-086-8008

English | 微信端

互联网药品信息服务资格证书编号:(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号
京公网安备 11010502027115号